Recommended For You
Herausforderung
- Verunreinigungen bei der Verpackung steriler Injektionslösungen bewirkten zweistellige Batch-Verluste jährlich.
Lösungen
- Manufacturing Intelligence - FactoryTalk-Softwareanwendungen speichern, organisieren und zeigen Daten aus Steuerungssystemen und ermöglichen automatische FDA-Berichte, präsentieren angepasste Berichte und stellen die Qualitätskontrolle sicher
- Manufacturing Intelligence - Automated Systems Inc. kombiniert Branchen-Know-how mit Systemdesign, Konfiguration, Realisierung, Validierung und Projektmanagement
Ergebnisse
- Einsparungen von mindestens 250 000 USD jährlich durch Senkung der Batch-Verluste auf null
- Die Fernüberwachung des Batch-Status ermöglicht einem einzelnen Bediener die Überwachung mehrerer Prozesse.
- Berichte werden im PDF-Format gespeichert und ermöglichen Batch-Rückverfolgbarkeit
- Historische Daten zur Trend- und Prozessanalyse verfügbar
- Mit rollenbasierten Key Performance Indicators (KPIs) konfigurierte Dashboard-Berichte bieten Bedienern und dem Management klare, aussagekräftige Informationen in Echtzeit
Hintergrund
Viele lebenswichtige Medikamente sind in den Vereinigten Staaten nur beschränkt lieferbar – eine Situation, die Patienten entrüstet und sogar zu Anhörungen im Kongress geführt hat. An oberster Stelle der Liste dringend benötigter Arzneien stehen Flüssigkeiten, die Patienten entweder per Injektion oder intravenös erhalten. Tatsächlich sind fast 75 Prozent der Medikamente auf der Fehlliste der US-amerikanischen Federal Food and Drug Administration Flüssigkeiten, etwa Arzneien für die Chemotherapie, Narkosemittel und Ernährungslösungen.
Die FDA und Branchenexperten stimmen darin überein, dass ein großer Teil des Problems von den strengen und oft komplexen Prozessen herrührt, die zum Schutz der Reinheit von Medikamenten in der Produktion nötig sind. Allein im Jahr 2010 musste mehr als die Hälfte der Batches injizierbarer Arzneien, die von Pharmaherstellern produziert wurden, wegen Qualitätsproblemen entsorgt werden, wie etwa Verunreinigung durch Bakterien und industrielle Partikel.
Die Geschichte eines Herstellers verdeutlicht den Ernst der Lage – und wie Unternehmen das Problem mithilfe automatisierter Technologie überwinden können.
Herausforderung
Verunreinigung an der Verpackungsstraße führte bei diesem US-amerikanischen Hersteller von sterilen Injektionslösungen zu einem zweistelligen Batch-Verlust jährlich. Das Problem im Prozess trat während des Transfers der Arznei von Sammelbehältern in einzelne Glasfläschchen mittels einer Blas-, Füll- und Siegelmaschine auf.
Um sicherzugehen, dass die gesamte Ausrüstung vor dem Einführen der Arznei steril war, setzte der Bediener die Fertigungslinie während des Vorgangs manuell durch Öffnen und Schließen einer Reihe von 20 bis 30 Ventilen unter Druck. Dadurch wurden Außenluft und Verunreinigungen verhindert. Wurde ein Ventil allerdings in der falschen Reihenfolge oder zur falschen Zeit geöffnet, konnte das den gesamten Batch verunreinigen.
Menschliches Versagen war nicht das einzige Problem. Eine defekte Ventildichtung oder Instrumentenkupplung konnte ebenfalls zu einem Druckverlust führen und damit die Reinheit des Produkts gefährden. Die Fertigungslinie verfügte zudem nicht über ein Alarmsystem, mit dem potenzielle Fehler angezeigt wurden. So wussten die Anlagenbediener nicht, ob der Batch zu gebrauchen war oder nicht, bis das Endprodukt getestet wurde.
Lösung
Auf der Suche nach einer umfassenden Lösung wandte sich der Arzneimittelhersteller an Automated Systems Inc. (ASI), um sein Steuerungs- und Visualisierungssystem aktualisieren zu lassen. ASI entwickelte ein System zur automatischen Eindämmung von Verunreinigungen an der Fertigungslinie. Das System löst Alarm aus, wenn Prozessmetriken vorgegebene Bereiche über- oder unterschreiten, und verfolgt und zeichnet wichtige Prozessdaten auf, mit denen die Sterilität jedes fertigen Batches verifiziert werden kann.
Die Lösung basierte auf einer Manufacturing Intelligence-Strategie mit Hard- und Software von Rockwell Automation. Mithilfe einer neuen programmierbaren ® ControlLogix®-Automatisierungssteuerung von Allen-Bradley konzipierten ASI-Ingenieure ein System, das sämtliche Schritte der Prozess- und Ablaufsteuerung vorherbestimmt, einschließlich des unerlässlichen Druckeinstellungsvorgangs.
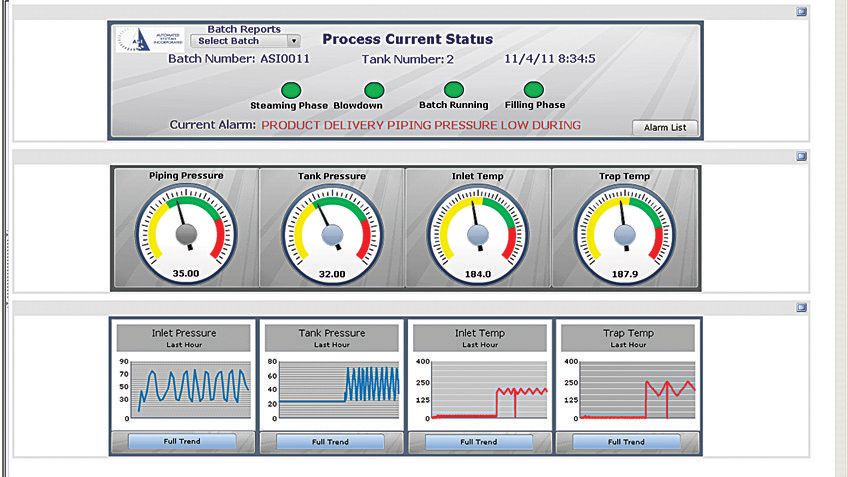
Das System umfasste FactoryTalk-Software von Rockwell Automation einschließlich einer Bedienerschnittstelle (HMI), auf der die FactoryTalk® View Site Edition (SE)-Software ausgeführt wird. Die Bedienerschnittstelle zeigt in Echtzeit den Status des Systems auf einem hochentwickelten Bildschirm als Illustration. Dieser Bildschirm – auf den auch zur dezentralen Überwachung über einen geschützten Webbrowser zugegriffen werden kann – gibt den Bedienern einen detaillierten Überblick über den Status jedes Ventils im gesamten System und zeigt die aktuellen Druck- und Temperaturwerte.
Dadurch kann der Bediener schnell und korrekt die richtige Aktion mit optimaler Kenntnis des gesamten Systems ausführen. Die FactoryTalk View SE-Software fordert den Bediener zu bestimmten Aktionen sowie zur Überprüfung von Variablen bei jedem Schritt des Prozesses auf. Im Fall einer Warnung oder eines Alarms identifiziert das System automatisch den Standort des potenziellen Ausfalls und resterilisiert die Fertigungslinie.
Zur verbesserten Datenhaltung und für einfachere Berichte integrierte ASI die Software FactoryTalk Historian und VantagePoint EMI in das neue System. Gemeinsam verfolgen und berichten die Anwendungen alle Parameter und Alarme kritischer Prozesse. Jetzt haben die Bediener in Echtzeit Zugriff auf wichtige Produktionsdaten über automatisch generierte Schnittstellen, Dashboards und Berichte. So können sie potenzielle Produktionsprobleme entschärfen, bevor sie auftreten. Darüber hinaus können Geschäftsleiter historische Daten auswerten und für fundiertere Entscheidungen nutzen.
Am Ende jedes Betriebszyklus erstellt das neue System automatisch einen Bericht, in dem alle Alarme und Bedingungen aufgeführt sind, die sich auf die Sterilität auswirken könnten. Wenn Bediener eine Abweichung bemerken, können sie sich auf die historischen Daten beziehen und genau ermitteln, wo der Fehler aufgetreten ist. So kann die Situation schnell geklärt werden. Die automatische Nachverfolgung der Produktionsdaten sorgt auch dafür, dass nicht jeder Batch am Ende des Prozesses getestet werden muss.
Die Berichte werden im PDF-Format gespeichert und ermöglichen Batch-Rückverfolgbarkeit. Die Anlagenbediener und Manager nutzen die historischen Daten zur Trend- und Prozessanalyse.
Die FactoryTalk Historian- und VantagePoint EMI-Software erfüllen zudem regulatorische Berichtsanforderungen. FactoryTalk Historian dient als sicheres Datensatz-Repository, das dem Hersteller hilft, die FDA-Regeln zu elektronischen Datensätzen einzuhalten. FactoryTalk VantagePoint EMI ermöglicht dem System die Zusammenführung zuverlässiger Unterstützungsdaten für den Batch-Datensatz. Das verbessert die Compliance mit den Vorschriften der Behörde zu anerkannten Herstellungspraktiken.
Ergebnis
Seit der Realisierung des neuen Systems hat der Hersteller keinen einzigen Batch wegen Verunreinigung verloren. Jeder fertig produzierte Batch ist mehr als 250 000 USD wert. So hat sich die Investition in das neue System schnell bezahlt gemacht.
Das Unternehmen verbringt auch weniger Zeit und Geld damit, die FDA-Berichtsvorschriften einzuhalten, denn das System verfolgt die Sicherheit jedes Batches automatisch.
Und schließlich haben auch die Patienten einen Nutzen davon, denn sie erhalten mehr benötigte Arzneien.
Veröffentlicht 28. Mai 2015