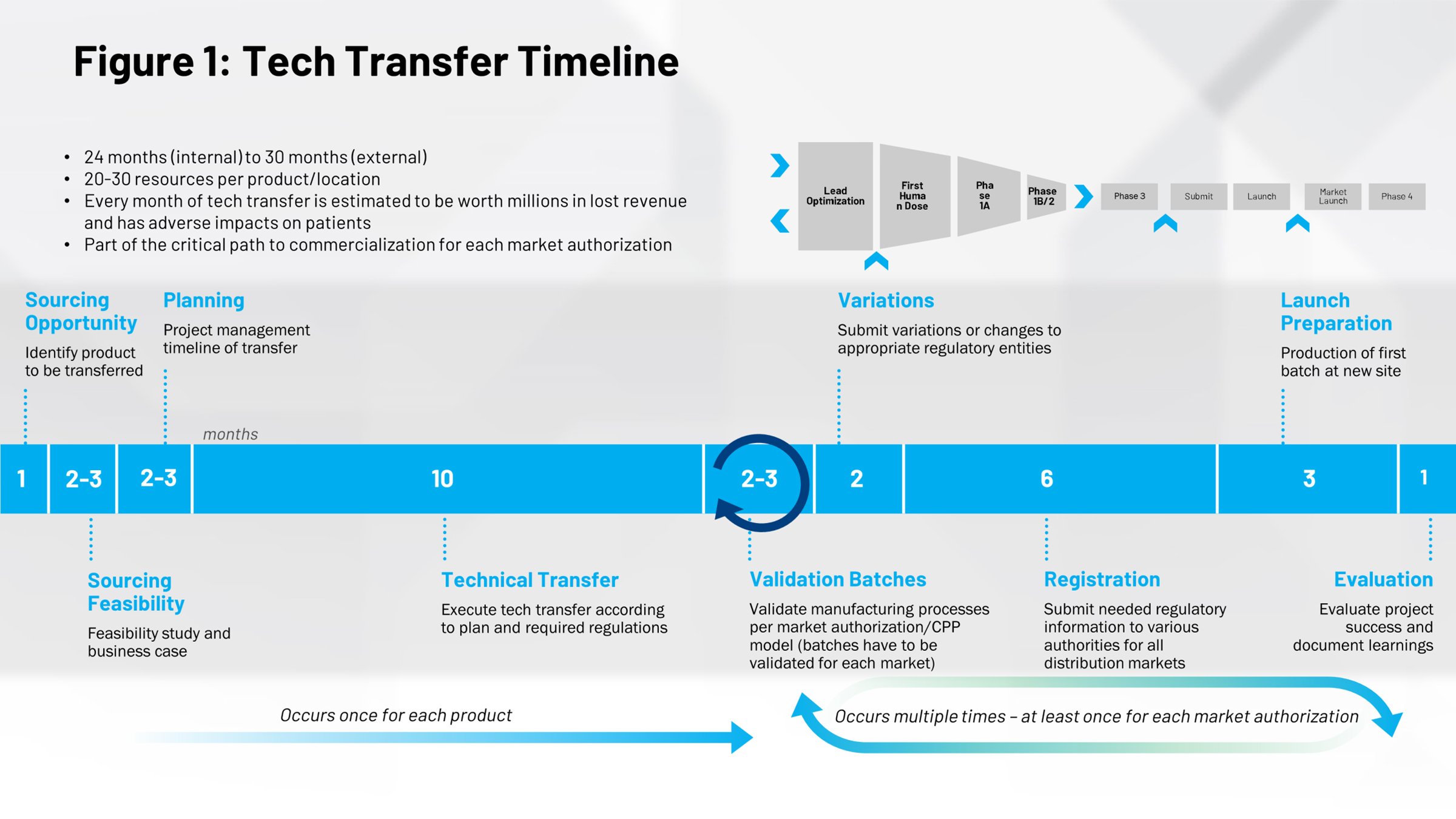
L’observation de la chronologie d’un événement type de transfert technologique (Figure 1) nous donne une perspective différente sur son impact. La première moitié couvre le processus de commercialisation des médicaments, 10 mois qui correspondent à la durée moyenne requise pour faire passer une recette au stade de lot commercial. Il y a là une formidable opportunité. Si vous exécutez ce processus plus efficacement, vous gagnez du temps qui permettra de mettre les médicaments plus rapidement sur le marché et plus tôt dans la durée de vie du brevet, de sorte que vous profitez de davantage de temps sous la protection du brevet.
Tout ce qui se trouve dans la moitié droite de la chronologie correspond à des cycles répétés qui se produisent lorsque vous effectuez des transferts technologiques supplémentaires, comme des transferts internes à votre entreprise d’un site à un autre site ailleurs dans le monde. Si vous pouvez numériser ces processus, si vous pouvez les rendre plus efficaces, plus répétables, les gains potentiels en temps et en effort sont considérables.
Qu’est-ce qui nous arrête ?
Alors, pourquoi nous y sommes-nous mal pris ? Quels sont les problèmes qui nous ont retenus ? Quels sont les défis à surmonter ? L’un d’eux relève du traitement et de la création de données.
Prenons le cas des processus de contrôle en chimie et fabrication (CMC), ils partent des attributs de qualité critique (CQA) qui sont connus, puis nous tentons d’élaborer les processus et les paramètres de processus clés nécessaires pour atteindre ces CQA. Mais, qu’il s’agisse des CQA dans l’élaboration des processus ou du cycle de production de la recette, il faut les intégrer au bout du compte dans vos déclarations réglementaires. Il faut les intégrer dans vos lots de validation et vos lots d’enregistrement.
Dans votre entreprise, les groupes qui travaillent sur ces questions auront besoin de ces informations pour prouver que vos recettes fonctionnent bien. Ensuite, certains aspects post-approbation autour de la gestion du changement, de la gestion d’un site à un autre et de l’élaboration de recette devront être mis en conformité.
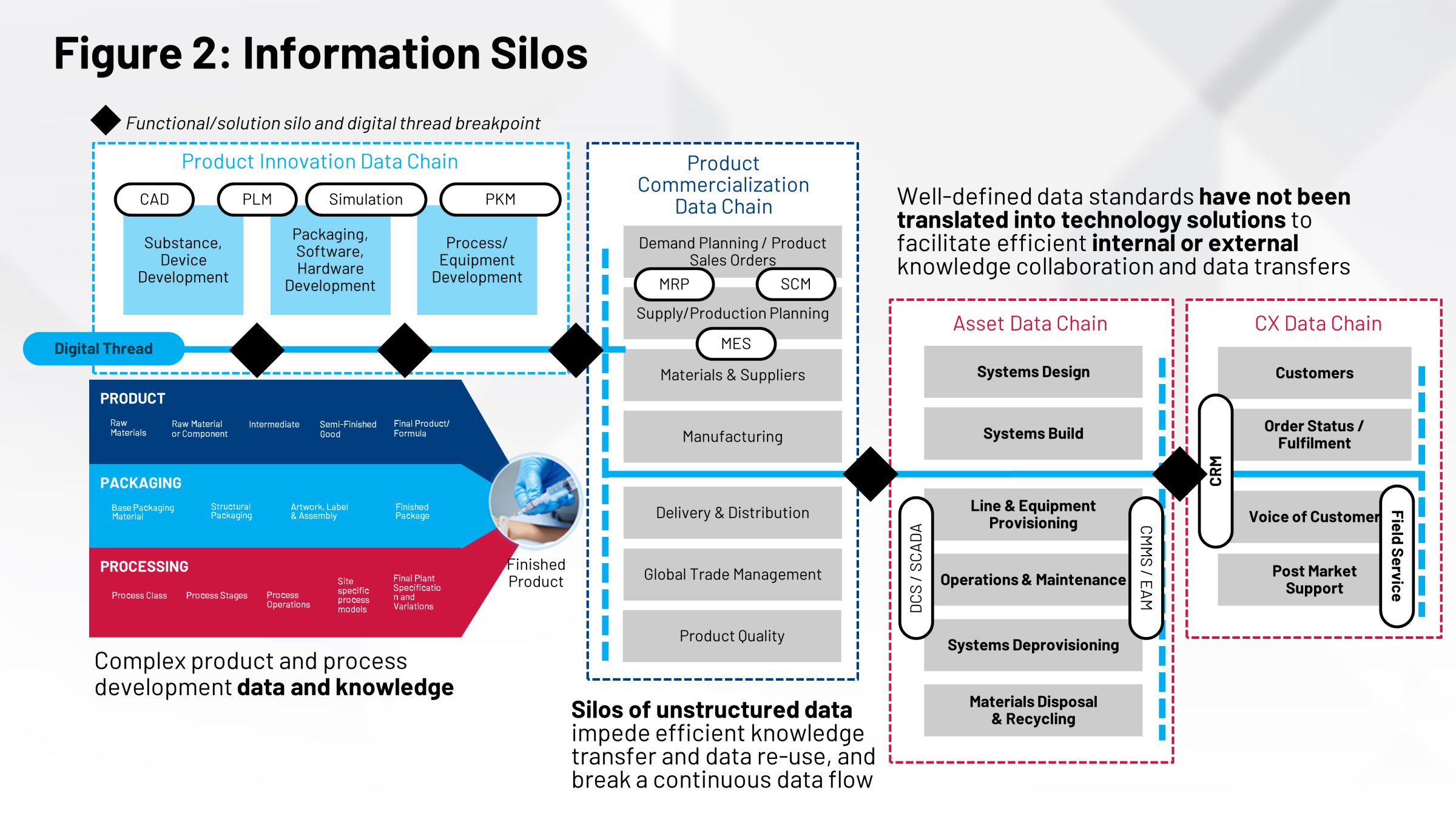
Et souvent, ces groupes ne travaillent pas ensemble à partir des mêmes informations. Il n’existe pas de référentiel commun, pas de système d’enregistrement unique de toutes les informations qui entrent dans la fabrication de ces produits. Au bout du compte, la multiplicité des interprétations possibles nuit à votre capacité à conduire efficacement le transfert technologique, la validation des process, les comparaisons entre sites et de nombreuses autres actions critiques.
L’absence de collaboration et de coordination dans ces domaines influe sur les systèmes de gestion qui aideront à fabriquer vos produits. Votre système de gestion de la production (MES) et votre système de contrôle-commande (DCS) ont tous deux besoin de ces informations. Dans le monde d’aujourd’hui, tous ces processus sont manuels : les registres papier, les transferts manuels et la simple énergie humaine déployée pour faire ces choses.
Sur la même longueur d’onde
Une autre façon d’examiner le problème est la suivante : vous disposez de multiples définitions portant sur l’emballage, les process et le produit, qui sont toutes indispensables pour exécuter des fonctions critiques. L’étiquetage de votre produit, le contenu de l’étiquette, la conception du produit et celle de l’emballage — autant d’informations essentielles qui proviennent toutes de groupes différents.