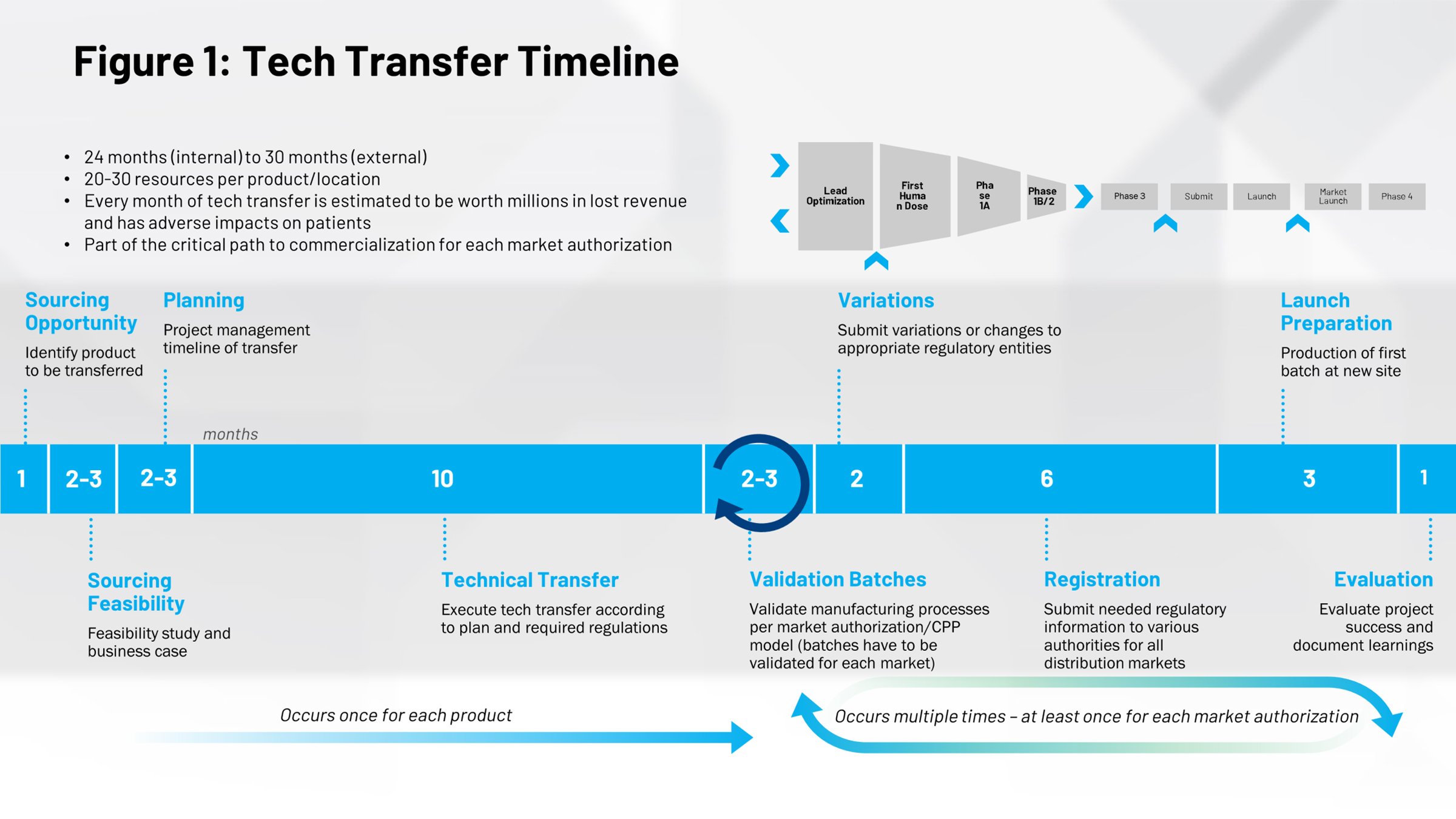
一般的な技術移転イベントのタイムライン(図1)を見ると、その影響について異なる視点が見えてきます。前半は薬剤を市場に出すまでのプロセスで、レシピをスケールアップして商業バッチ段階に到達するまでに必要な平均時間は10か月です。ここに絶好の機会があります。このプロセスをより効率的に実行できれば、時間を節約して特許期間の早い段階で迅速に医薬品を市場に投入することができるため、特許保護期間が長くなります。
タイムラインの右半分にあるものはすべて繰り返しのサイクルで、組織の他の部分から世界中の各施設への内部移転など、追加の技術移転を実行する際に発生します。これらのプロセスをデジタル化し、より効率的で反復可能なものにすれば、時間と労力を大幅に節約できる可能性があります。
妨げとなる要因
では、なぜこれを適切に実行できないのでしょうか。私たちの妨げとなっている問題は何なのでしょうか。克服しなければならない課題は何でしょうか。その1つは処理および作成されるデータです。
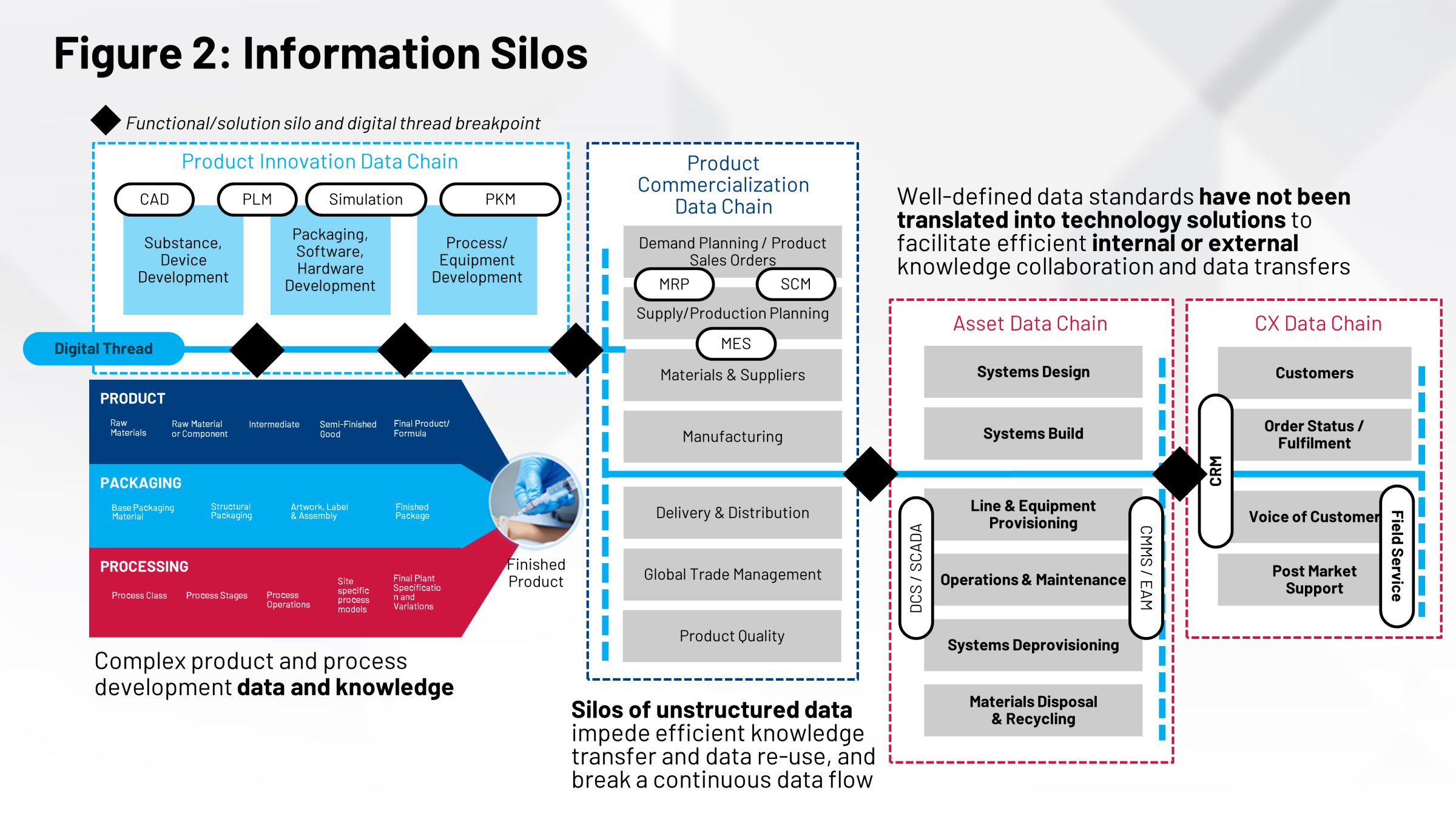
化学、製造、品質管理(CMC)プロセスにはご存じのとおり、重要品質特性(CQA)が含まれます。そのため、CQAを満たすために必要なプロセスと主要なプロセスパラメータの開発を試みます。ただし、プロセス開発およびプロセスレシピのサイクルのCQAは、最終的には規制当局への提出物に組み込む必要があります。つまり、検証バッチと登録バッチに組み込む必要があります。
組織内でこれらの分野に取り組んでいるグループは、レシピが実際に機能することを証明するために、その情報を必要とします。その後、変更管理、施設間管理、レシピ開発など、承認後の懸念事項を調整する必要があります。
多くの場合、これらのグループは同じ情報に基づいて一緒に作業しているわけではありません。製品の製造に関わるすべての情報を記録した共通のリポジトリや単一のシステムはありません。突き詰めると、単一の情報源がないため、効果的な技術移転、プロセス検証、施設間の比較、その他さまざまな重要な作業を、最も効率的な方法で実行することができません。
それらを連携させて調整できなければ、製品の製造を支援する実行システムに影響を及ぼします。製造実行システム(MES)と分散型制御システム(DCS)にはそのような情報が必要になります。今日の世界では、紙の記録、手作業による転送、人的リソースの膨大な能力など、手作業によるプロセスを通じて、これらのことを行なっています。
共通認識
これを確認するもう1つの方法は、重要な機能を実行するために必要な、梱包、プロセス、製品に関する定義を持つことです。製品へのラベル付け、ラベルの内容、製品設計、パッケージデザインなど、これらはすべて重要な情報であり、それぞれ異なるグループによって開発されています。