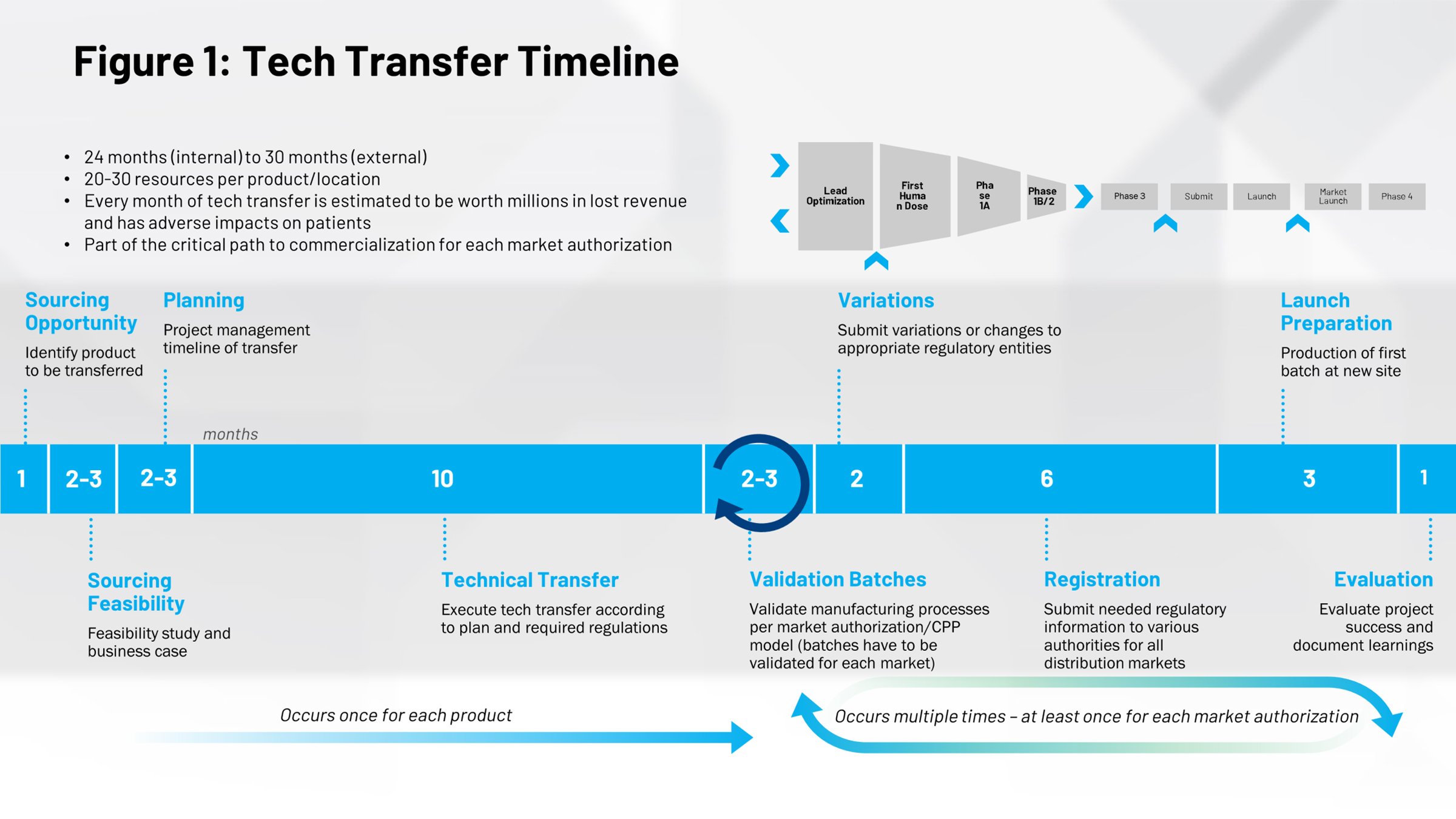
일반적인 기술 이전의 타임라인(그림 1)을 살펴보면 기술 이전의 영향을 다른 관점으로 볼 수 있습니다. 전반부는 의약품을 시장에 출시하는 과정이고, 그중 10개월은 레시피를 스케일업하고 상업적 배치 단계에 도달하는 데 필요한 평균 시간입니다. 여기에 엄청난 기회가 있습니다. 이 프로세스를 더욱 효율적으로 실행할 수 있다면 시간을 절약해 특허 동안 더 빠르고 더 일찍 의약품을 출시할 수 있으므로 더 오래 특허 보호를 받을 수 있습니다.
타임라인의 오른쪽 절반에 있는 모든 것은 조직의 어떤 부분에서 전 세계 다른 현장으로의 내부 이전 같은 추가적인 기술 이전 수행을 할 때 발생하는 반복 사이클입니다. 이러한 프로세스를 디지털화하고 더 효율적이고 반복할 수 있게 만들 수 있다면 시간과 노력을 크게 절약할 수 있습니다.
우리를 가로막고 있는 것들
그렇다면 왜 이것을 제대로 하지 않고 있을까요? 어떤 문제가 우리를 가로막고 있을까요? 극복해야 할 과제는 무엇일까요? 그중 하나는 데이터의 처리와 생성입니다.
화학 및 제조 제어(CMC) 프로세스를 살펴보면, 이미 알고 있는 핵심 품질 특성(CQA)을 취한 다음 이러한 CQA를 달성하는 데 필요한 프로세스와 핵심 프로세스 매개변수를 개발합니다. 그러나 프로세스 개발 및 프로세스 레시피 사이클에서 CQA는 궁극적으로 규제 문서에 포함되어야 하고, 검증 배치와 등록 배치에도 포함되어야 합니다.
이를 담당하는 조직 내 그룹들은 레시피가 실제로 작동하는지 증명하기 위해 관련 정보가 필요합니다. 그런 다음 변경 관리, 현장별 관리 및 레시피 개발과 관련된 승인 후 문제를 조정해야 합니다.
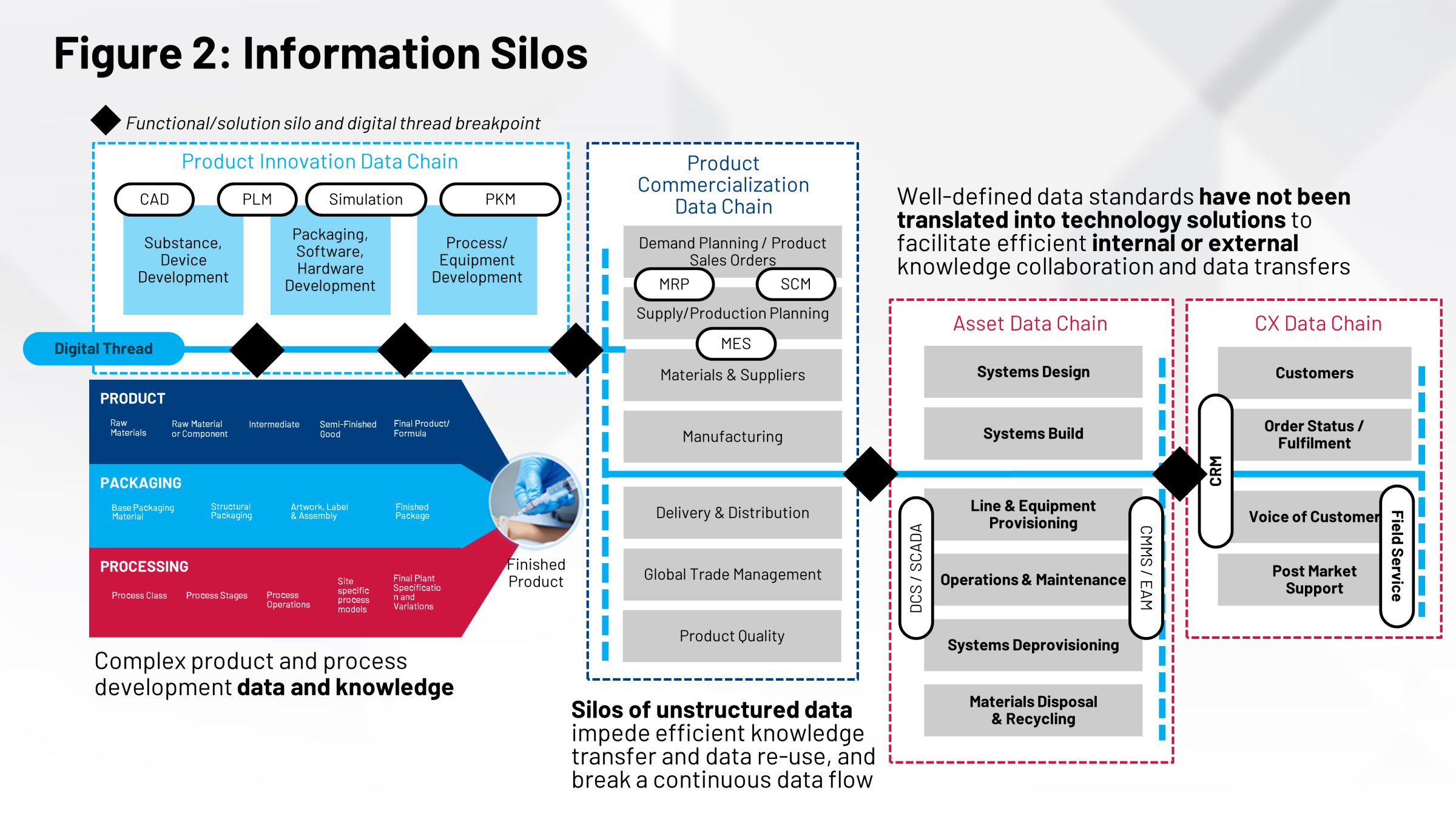
이 그룹들은 동일한 정보를 놓고 함께 작업하지 않는 경우가 많습니다. 공통된 리포지토리가 없고, 해당 제품의 제조에 필요한 모든 정보를 기록하는 단일 시스템도 없습니다. 궁극적으로 단일 버전의 정보가 없기 때문에 효과적인 기술 이전, 프로세스 검증, 사이트 간 비교 및 기타 여러 핵심 작업을 가장 효율적인 방식으로 수행하는 능력에 영향을 미칩니다.
이러한 요소들이 함께 작동하지 않고 조정되지 않으면 제품 생산을 지원하는 실행 시스템에 영향을 미칩니다. MES(제조 실행 시스템)와 DCS(분산 제어 시스템)에는 이러한 정보가 필요합니다. 현재는 문서 기록, 수동 이전, 이러한 작업을 수행하는 인적 자원 등 수동 프로세스를 통해 이를 수행합니다.
같은 목표를 위한 합심
이를 바라보는 또 다른 방법은 핵심 기능을 수행하는 데 필요한 포장, 프로세스 및 제품에 대한 정의를 살펴보는 것입니다. 제품의 라벨, 라벨의 내용, 제품 디자인, 포장 디자인은 모두 핵심 정보이고 모두 서로 다른 그룹에서 개발합니다.