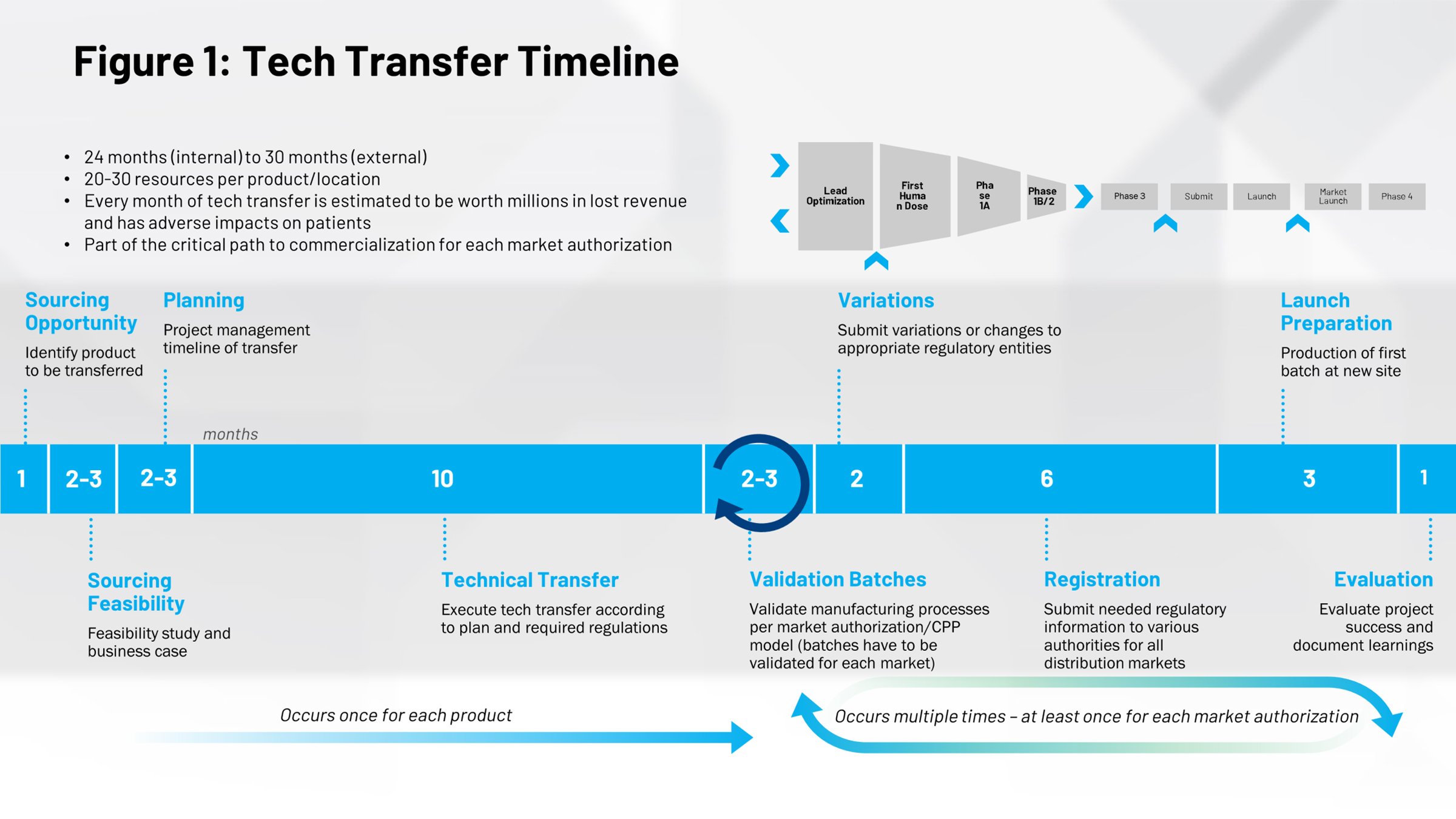
Olhando para a linha do tempo de um evento de transferência de tecnologia (Figura 1) nos dá uma perspectiva diferente de seu impacto. A primeira metade abrange o processo de colocar os medicamentos no mercado, 10 meses dos quais é o tempo médio necessário para escalonar uma receita e alcançar o estágio de lote comercial. Há uma ótima oportunidade aqui. Se você puder executar esse processo de forma mais eficiente, você reduzirá o tempo de lançamento do medicamento do mercado e antecipar a patente para que você tenha mais tempo sob a proteção de patentes.
Tudo que está na metade direita da linha do tempo é ciclos repetidos que acontecem quando você faz outras transferências de tecnologia, como transferências internas de outras partes de sua empresa para um local separado ao redor do mundo. Se você puder digitalizar esses processo, se puder realizá-los de forma mais eficiente, mais repetível, há um potencial de economia significativo de tempo e esforço.
O que está nos impedindo?
Então por que não fazemos corretamente? Quais os problemas que nos impedem? Quais são os desafios que precisamos superar? Um é obter os dados processados e criados.
Se você analisar os processos de controle de química e produção (CMC), eles usam os atributos críticos de qualidade (CQAs) que conhecemos e tentamos desenvolver os processos e os principais parâmetros de processo que precisamos para atingir esses CQAs. Porém, os CQAs no desenvolvimento de processo e o ciclo da receita do processo precisam ser construídos de acordo com as regulamentações. Eles precisam ser construídos em seus lotes de validação e seus lotes de registro.
Os grupos dentro da organização que trabalham nessas áreas precisarão dessas informações para comprovar que suas receitas realmente funcionam. Depois, há preocupações pós-aprovação sobre a gestão de mudanças, gestão de local a local e desenvolvimento de receitas que precisam alinhar.
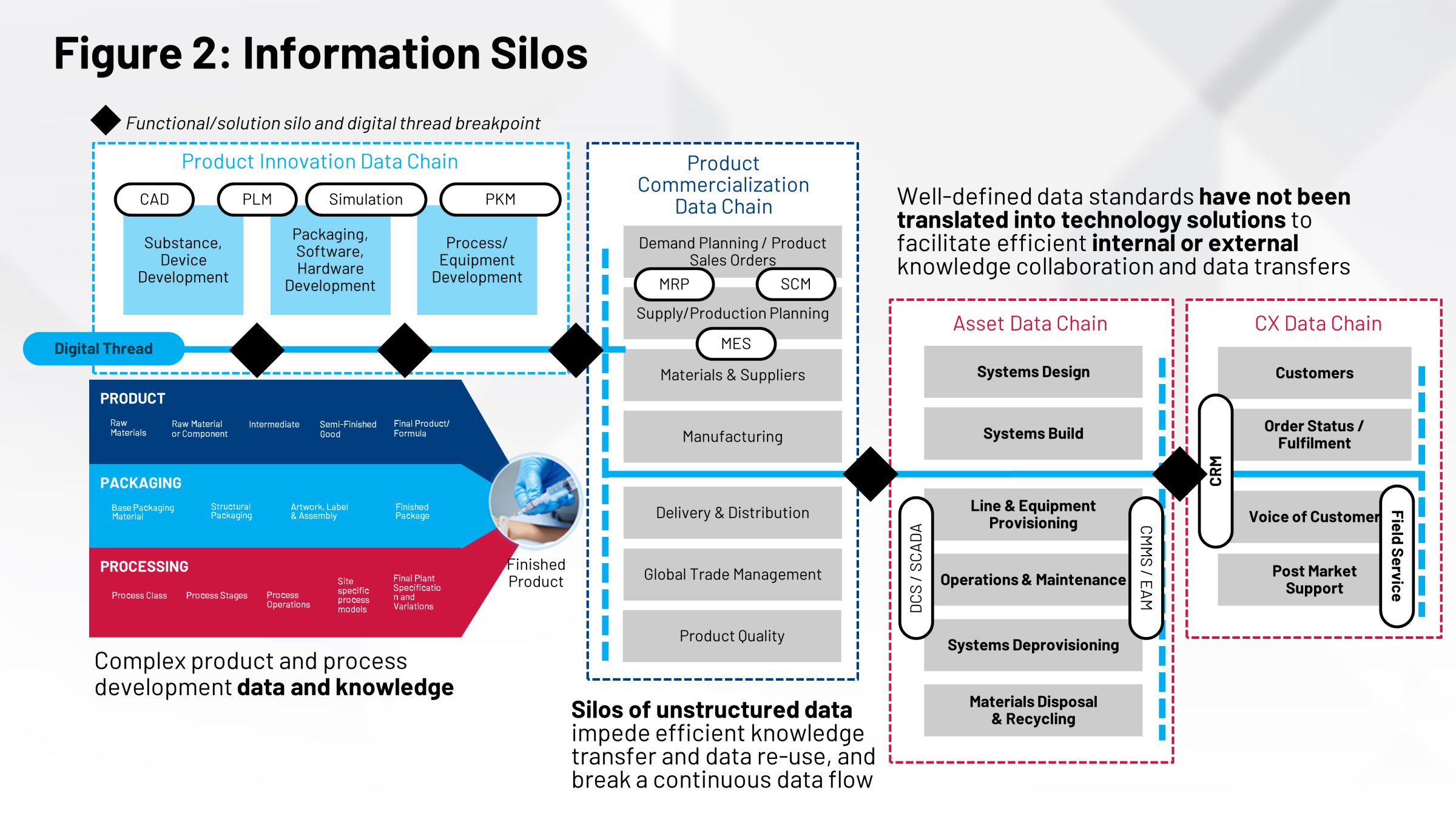
Geralmente, esses grupos não estão trabalhando juntos na mesma parte da informação. Não é um repositório comum, nenhum sistema único de registro de todas as informações que vão da produção desses produtos. Por fim, como você não tem uma única versão da verdade, isso afeta sua capacidade de fazer a transferência de tecnologia, validação do processos, comparações local ao local e muitas outras ações críticas da forma mais eficiente.
Não ter tudo trabalhando junto e coordenado afeta os sistemas de execução que ajudam a fabricar seus produtos. Seu sistema de execução de manufatura (MES) e seu sistema de controle distribuído (DCS) precisam dessas informações. Na atualidade, fazemos isso através de processos manuais: registros em papel, transferências manuais e poder absoluto dos recursos humanos.
Na mesma página
Uma outra maneira de analisar isso é ter definições sobre sua embalagem, seu processo e produto que são necessárias para realizar funções críticas. A etiqueta em seu produto, o conteúdo na etiqueta, o projeto do produto, o design de embalagem — são partes da informação que foram desenvolvidas por grupos diferentes.