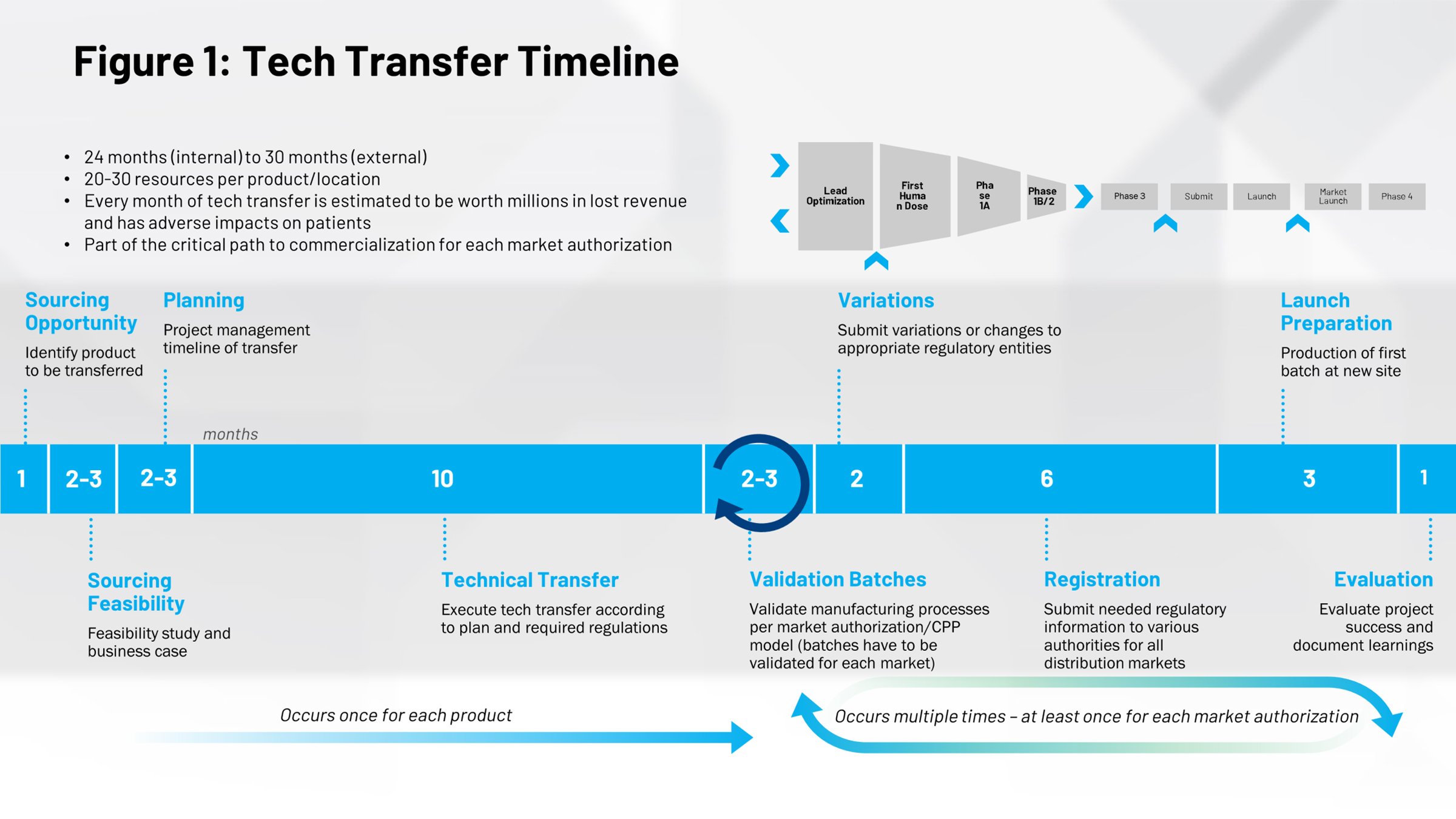
觀察一個標準的技術轉移事件 (圖 1) 能讓我們對它們的衝擊有不同的看法。前半段涵蓋了藥品上市的過程,其中將配方擴大並達到商業量產階段所需的平均時間是 10 個月。這裡頭存在著很大的機會。若您可以用更有效率的方式執行這個過程,那節省下來的時間就可以讓藥品在專利生命週期內更快且更早上市,讓您受到專利保護的時間更久。
時程右半邊是一些您所執行的其他技術轉移,例如從公司其他部分內部轉移到世界上某個獨力據點時的重複性過程。若您將這些流程數位化、讓它們更有效率、更有可重複性,那麼就有很大的機會可以節省時間與心力。
是什麼讓我們停下腳步?
那麼為何我們還未能將這件事做好呢? 讓我們停滯不前的問題是什麼? 有哪些挑戰需要去克服? 其中一個就是要去處理及建立資料。
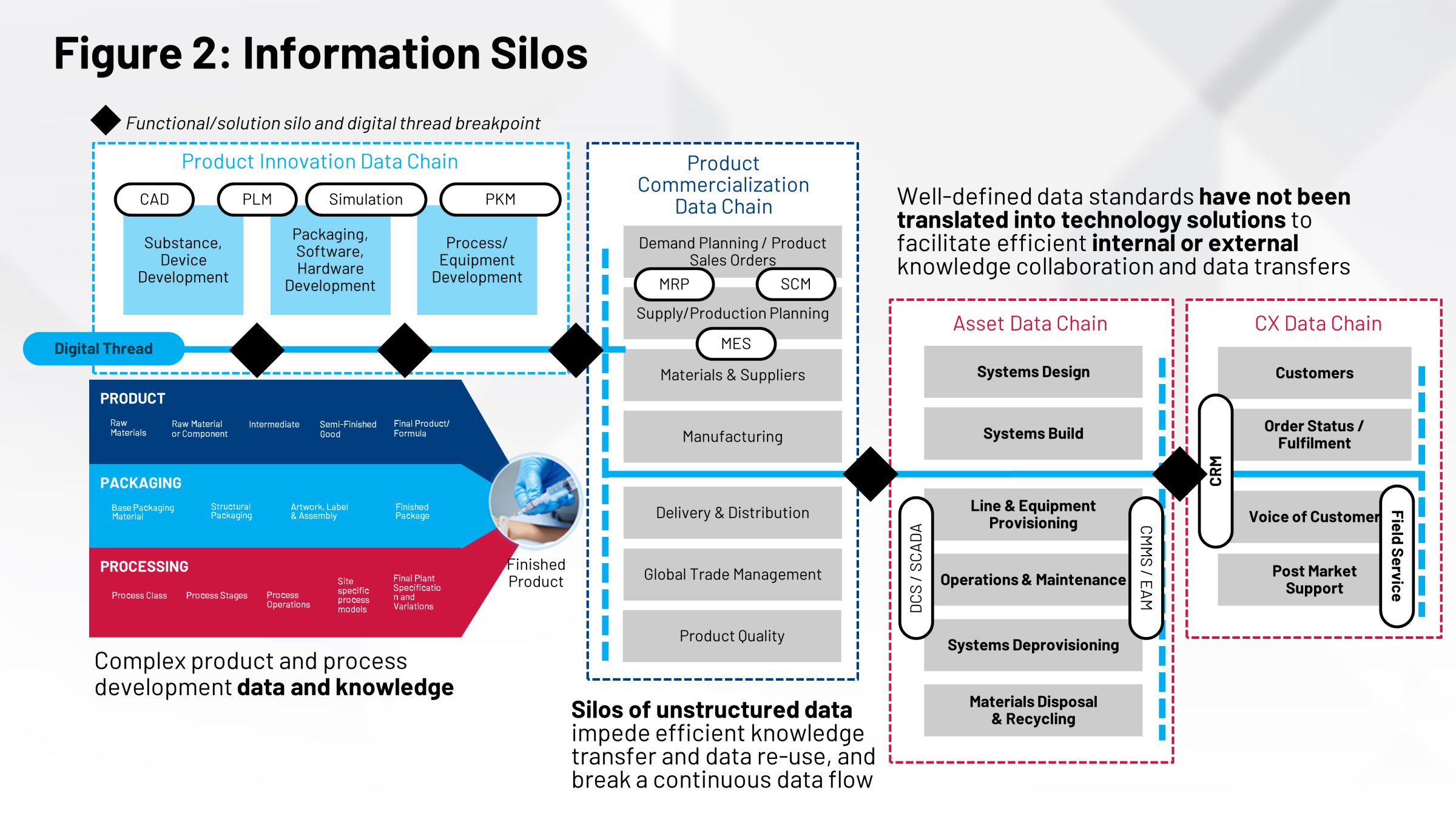
如果您看這些化學與製造控制 (CMC) 過程,會發現他們採用了我們所知的一些關鍵品質屬性 (CQA),然後我們會根據需要試著開發製程與關鍵製程參數,以便達到這些 CQA。但製程開發與製程配方週期中的 CQA 終究必須在您的監管文件中建立起來。它們必須建立到您的驗證批量與登記批量中。
組織內負責這些領域的小組會需要這些資訊來證明您的配方真的有效。然後還會有一些和變更管理、據點間管理及配方開發有關的事後查核需要協調。
通常,這些小組作業時不會有相同的資訊。對於與製造這些產品有關的所有資訊,並沒有共同的資料庫,也沒有單一的系統能做記錄。最終,因為您在資訊上的落差,所以影響到您以最有效率的方式進行有效技術轉移、製程驗證、據點間比較及其他重要工作等的能力。
這些事情沒有同步與協調,會對幫助您製造產品的執行系統造成影響。您的製造執行系統 (MES) 與分散式控制系統 (DCS) 都需要這個資訊。在現今的世界中,我們會透過手動流程,如紙本記錄、手動轉移及其他純人工作業來搞定。
同步協調
另一個觀點是,在您的包裝、製程與產品周圍會有各種執行重要功能所需的定義。包括為產品打上標籤、標籤上的內容、產品設計與包裝設計等,都是關鍵資訊的一部分,且由不同的小組開發而來。