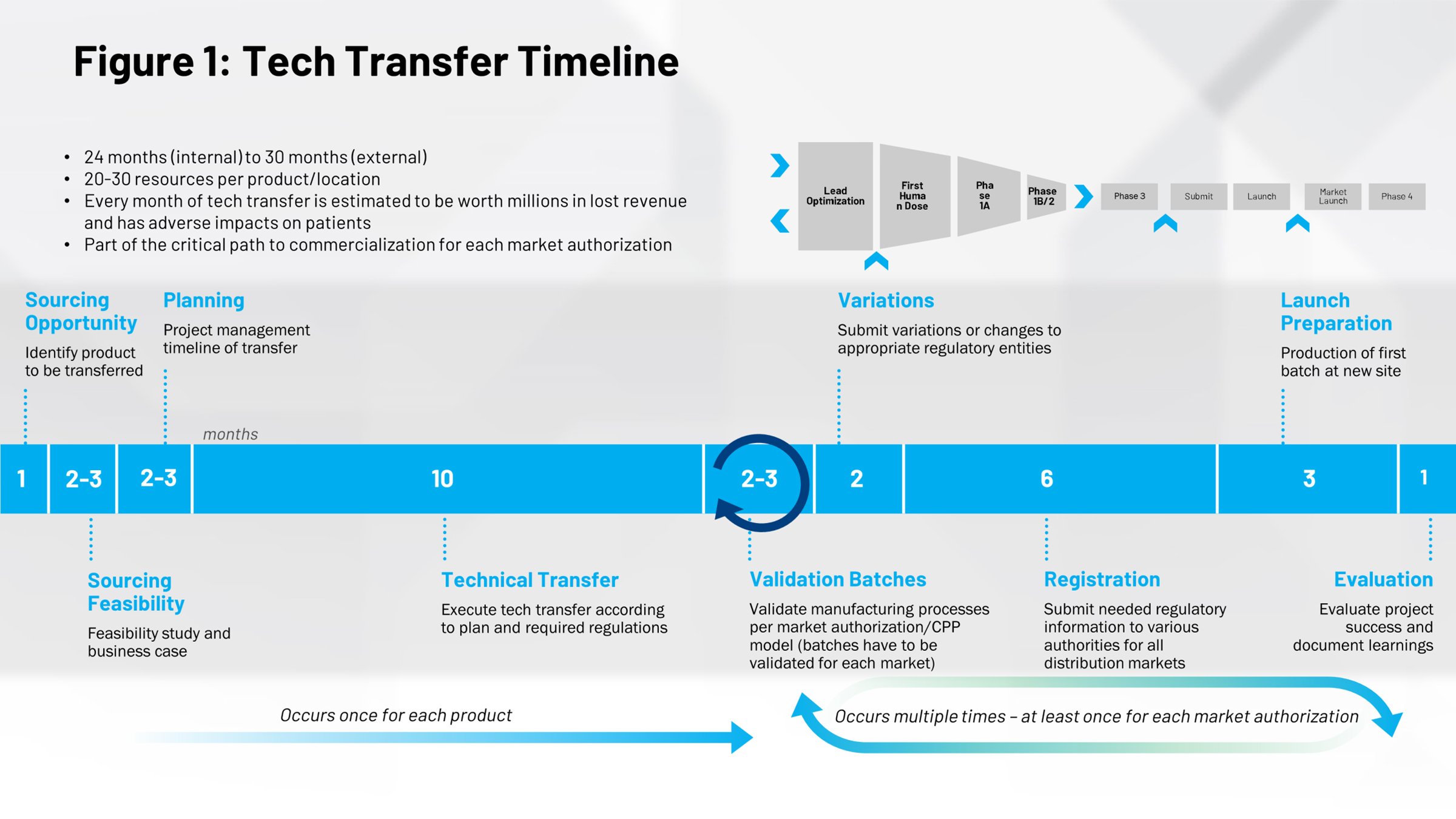
Ein Blick auf den zeitlichen Ablauf eines typischen Technologietransfers (Abbildung 1) gibt uns eine andere Perspektive auf deren Auswirkungen. In der ersten Hälfte geht es um den Prozess der Markteinführung von Arzneimitteln. Um eine Rezeptur bis zur Marktreife zu entwickeln, dauert es im Durchschnitt 10 Monate. Hier liegt eine enorme Chance. Wenn Sie diesen Prozess effizienter durchlaufen, sparen Sie Zeit. So können Sie Arzneimittel schneller und früher auf den Markt bringen und verlängern damit die Dauer des Patentschutzes.
Alles, was sich in der rechten Hälfte der Zeitleiste befindet, sind sich wiederholende Zyklen, zu denen es kommt, wenn Sie zusätzliche Technologietransfers durchführen, z. B. interne Transfers von anderen Teilen Ihres Unternehmens an einen anderen Standort in der Welt. Wenn es gelingt, diese Prozesse zu digitalisieren, sie effizienter und wiederholbar zu machen, ergeben sich erhebliche Zeit- und Kosteneinsparungen.
Was hält uns davon ab?
Warum läuft es hier noch nicht rund? Welche Probleme stehen uns im Weg? Welche Herausforderungen müssen wir bewältigen? Zum einen geht es um die Verarbeitung und Erstellung von Daten.
Schauen wir uns einmal die Abläufe bei der Chemie- und Herstellungskontrolle (CMC) an: Dabei werden die bekannten kritischen Prozess- und Qualitätsparameter (CQA) zugrunde gelegt und wir versuchen, die Prozesse und wesentlichen Prozessparameter zu entwickeln, um diese CQAs zu erreichen. Doch die CQAs in der Prozessentwicklung und der Prozessrezeptzyklus müssen letztendlich in Ihre Zulassungsanträge einfließen. Sie müssen in Ihre Validierungs- und Registrierungschargen eingebunden werden.
Die dafür zuständigen Teams innerhalb Ihrer Organisation benötigen diese Informationen, um nachzuweisen, dass Ihre Rezepte einwandfrei funktionieren. Außerdem müssen nach der Zulassung alle Belange rund um das Veränderungsmanagement, Site-to-Site-Management und die Rezeptentwicklung abgestimmt werden.
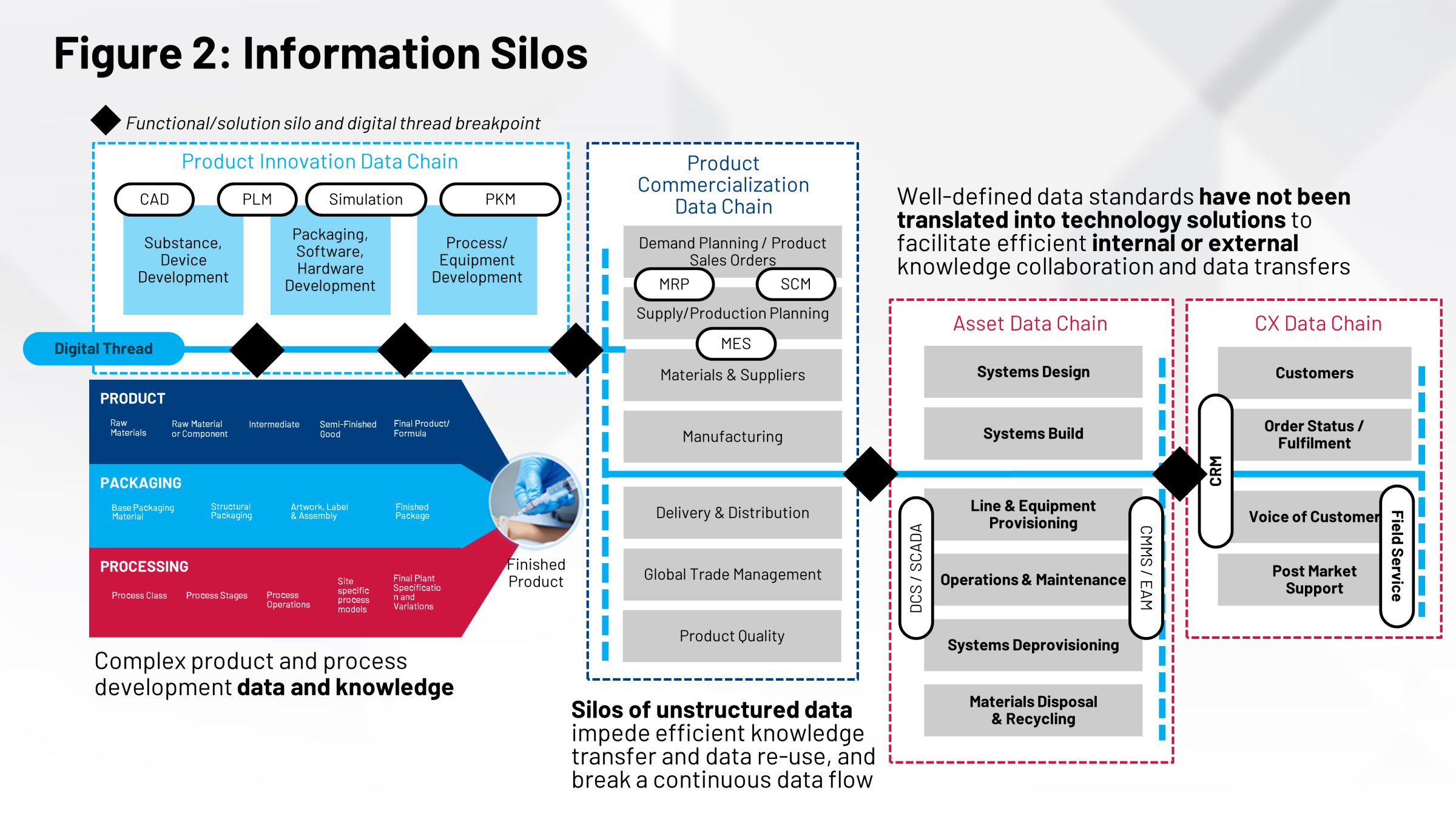
Häufig ist die Datenbasis, auf die sich die Teams beziehen, nicht dieselbe. Es gibt keinen gemeinsamen Speicherort, kein einheitliches Aufzeichnungssystem für die Gesamtheit an Daten, die zur Herstellung der Produkte herangezogen werden. Ohne eine einzige, zuverlässige Datenquelle ist es aber nicht möglich, eine hohe Effizienz bei Technologietransfer, Prozessvalidierung, Standortvergleichen und bei weiteren wichtigen Maßnahmen zu erreichen.
Eine mangelhafte Zusammenarbeit und Koordination wirkt sich auf die Ausführungssysteme aus, die bei der Herstellung Ihrer Produkte zum Einsatz kommen. Ihr Manufacturing Execution System (MES) und Ihr Prozessleitsystem (DCS) sind auf diese Informationen angewiesen. Heute verlassen wir uns bei diesen Arbeiten auf manuelle Prozesse: Papieraufzeichnungen und manuelle Übertragungen, verbunden mit einem erheblichen Personaleinsatz.
Auf der gleichen Seite
Man kann es auch so sehen, dass es Definitionen für Ihre Verpackung, Ihren Prozess und Ihr Produkt gibt, die für die Ausführung kritischer Funktionen erforderlich sind. Die Etikettierung Ihres Produkts, der Inhalt des Etiketts, das Produktdesign, das Verpackungsdesign – all das sind wichtige Informationen, die von verschiedenen Gruppen entwickelt werden.