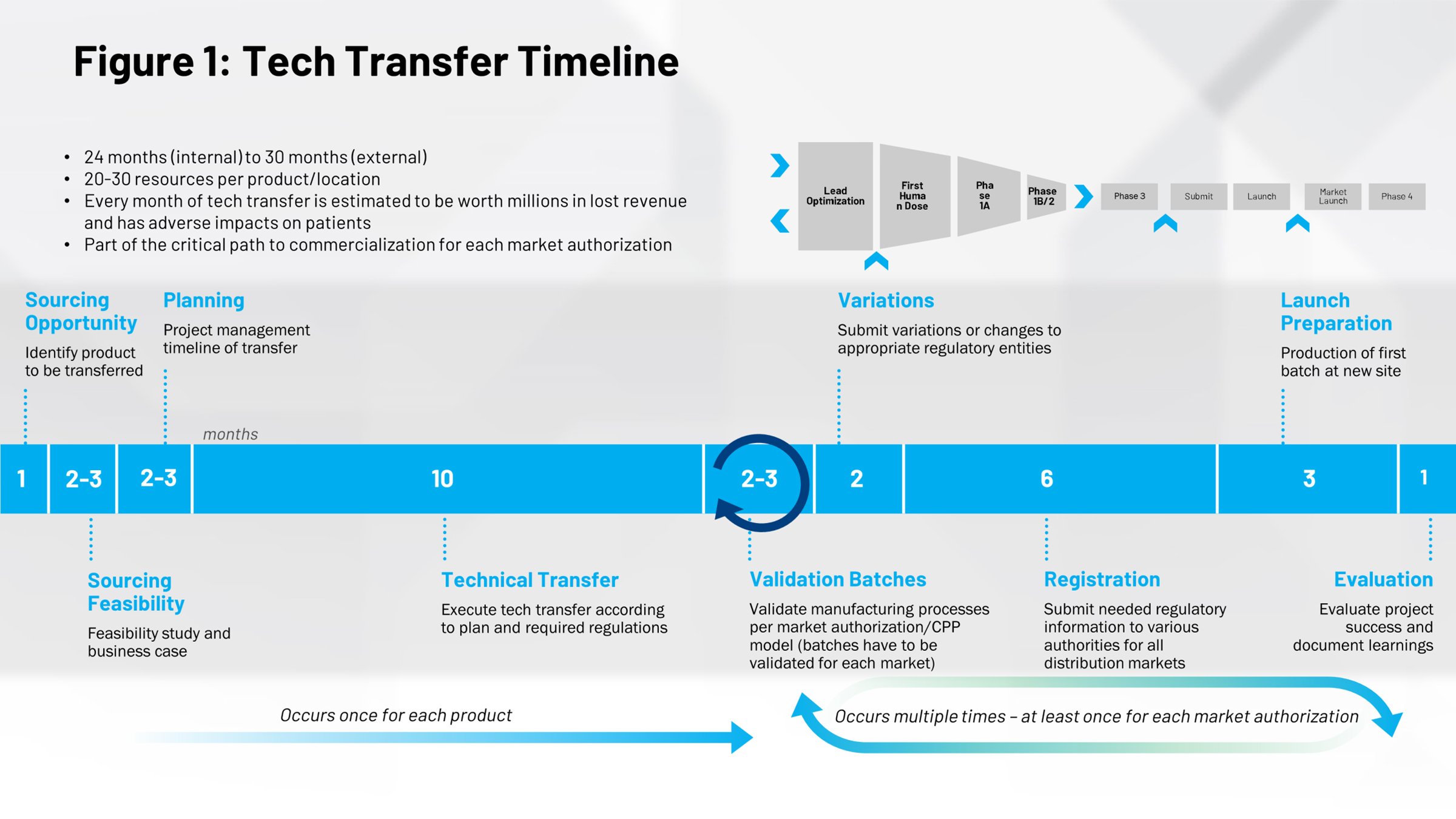
Guardando la cronologia di un tipico evento di trasferimento tecnologico (Figura 1) si ha una prospettiva diversa riguardo al loro impatto. La prima metà della figura riguarda il processo di immissione sul mercato dei farmaci, per cui 10 mesi è il tempo medio necessario per passare dalla ricetta alla fase di produzione commerciale. Qui c’è un’enorme opportunità. Se si riesce a eseguire questo processo in modo più efficiente, è possibile risparmiare tempo per portare i farmaci sul mercato più velocemente e in una fase iniziale della vita brevettuale, in modo da essere protetti dal brevetto per un periodo maggiore.
Tutto ciò che si trova nella metà destra della sequenza temporale sono cicli ripetuti che si verificano quando si eseguono ulteriori trasferimenti tecnologici, ad esempio trasferimenti interni da altre aree dell’azienda a un sito diverso in un’altra parte del mondo. Se si riesce a digitalizzare questi processi, a renderli più efficienti e ripetibili, il potenziale risparmio di tempo e fatica è notevole.
Quali sono gli ostacoli?
Perché non ci siamo riusciti finora? Quali sono i problemi che ci hanno frenato? Quali sono le sfide che dobbiamo superare? Uno di questi ostacoli è costituito dai dati che vengono processati e creati.
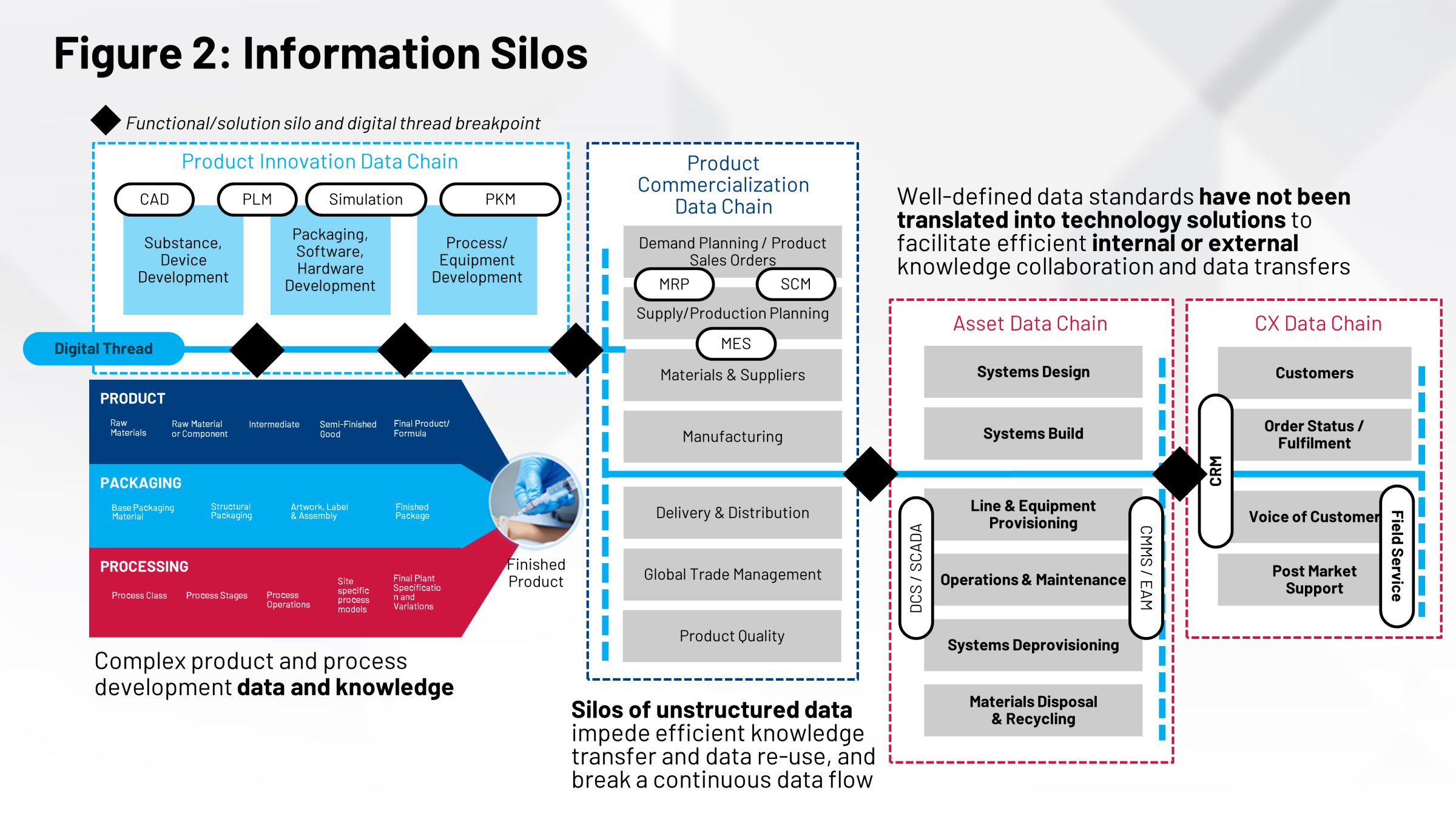
Se guardiamo all’attività di chimica, fabbricazione e controllo (CMC), essa parte dai CQA (attributi critici di qualità), per poi sviluppare i processi e i parametri chiave necessari per raggiungere tali CQA. Ma i CQA nello sviluppo del processo e nel ciclo di ricette del processo devono essere integrati nei documenti normativi. Devono essere integrati nei lotti di validazione e nei lotti di registrazione.
Il personale della vostra azienda che si occupa di queste aree avrà bisogno di queste informazioni per dimostrare che le vostre ricette funzionano davvero. Vi sono poi le attività post-approvazione relative alla gestione delle modifiche, alla gestione dei vari siti e allo sviluppo delle ricette che devono essere armonizzate.
Spesso questi gruppi di persone non lavorano insieme sulla base delle stesse informazioni. Non esiste un archivio comune, né un sistema di registrazione unico per tutte le informazioni che vengono utilizzate nella produzione di questi prodotti. In ultima analisi, non disponendo di un’unica fonte di informazioni, ciò si ripercuote sulla capacità di eseguire nel modo più efficiente possibile il trasferimento tecnologico, la validazione dei processi, il confronto tra i siti e molte altre azioni critiche.
Il fatto che questi elementi non interagiscano tra loro e non siano coordinati, si riflette sui sistemi di gestione che contribuiscono alla realizzazione dei vostri prodotti. Il sistema di gestione della produzione (MES) e il sistema di controllo distribuito (DCS) hanno bisogno di queste informazioni. Nel mondo di oggi, tutto ciò avviene attraverso processi manuali: registri cartacei, trasferimenti manuali e la sola capacità delle risorse umane che portano a termine queste operazioni.
Una visione comune
Un altro modo di affrontare il problema è quello di avere una serie di definizioni relative al packaging, al processo e al prodotto necessarie a svolgere le funzioni più importanti. L’etichettatura del prodotto, il contenuto dell’etichetta, il design del prodotto, il design della confezione: sono tutte informazioni fondamentali, sviluppate da gruppi di persone diversi.